Что такое пар? Часть 1
Чтобы лучше понять свойства пара, необходимо рассмотреть и понять общую молекулярную и атомную структуру вещества. А затем применить эти знания в отношении льда, воды и пара.
Молекула – это наименьшее возможное количество любого простого или сложного вещества, обладающая всеми его химическими свойствами. Сами молекулы состоят из еще меньших частиц, называемых атомами.
Атомы представляют собой основные химические элементы, такие как водород и кислород.
В особых комбинациях эти атомные элементы составляют сложные вещества. Одним из таких веществ является вода. Представляется химической формулой Н2О. Молекула воды состоит из двух атомов водорода и одного атома кислорода.
Высокая распространённость водорода и кислорода во Вселенной обусловливает значительное количество воды на Земле.
Еще один распространённый элемент, углерод, является ключевым компонентом всех органических веществ.
Большинство минеральных веществ могут существовать в трех физических состояниях: твёрдом, жидком и газообразном. Их так и называют – три состояния вещества. Для обозначения трёх агрегатных состояний H₂O используются термины: лёд (твёрдое), вода (жидкое), пар (газообразное).
Молекулярная структура льда, воды и пара пока что до конца не изучена. Молекулы воды соединены водородными связями, образующимися вследствие электростатического взаимодействия электрических зарядов.
Физическое состояние вещества определяется степенью возбуждения молекул.
Тройная точка
Три фазы вещества существуют одновременно лишь при конкретных температуре и давлении. Эти условия называют «тройной точкой».
Тройная точка H₂O: температура 273,16К, давление 0,006112 бар абс., равновесие фаз льда, воды и пара.
Это давление чрезвычайно близко к абсолютному вакууму. При снижении давления ниже тройной точки лёд минуя жидкую фазу переходит непосредственно в пар.
Лёд
Молекулы льда соединены между собой и образуют упорядоченную структуру. Они могут только вибрировать. В твёрдом состоянии движение молекул в решётке представляет собой колебания около среднего положения «привязки». Молекулы при этом находятся друг от друга на расстоянии менее одного диаметра молекулы.
Нагрев вызывает усиление колебаний молекул льда, приводящее к плавлению и переходу в жидкость. При атмосферном давлении лёд плавится при температуре 0ºС. Изменение давления оказывает на температуру плавления очень незначительное влияние. Из практических соображений почти всегда за температуру плавления льда принимают 0ºС. Было установлено, что при увеличении давления на одну атмосферу температура плавления льда уменьшается на 0,0072ºС.
Например при давлении 13,9 бар изб. температура плавления льда уменьшается на 0,1ºС.
Энтальпия плавления — тепло, разрушающее кристаллическую решетку без повышения температуры. А замерзание сопровождается выделением равного количества теплоты, поглощенной при плавлении.
Плотность большинства веществ при переходе из твёрдого состояния в жидкое уменьшается. Однако Н2О является исключением из этого
правила. Плотность этого вещества при превращении льда в воду увеличивается. Именно поэтому лед плавает на поверхности воды.
Вода
В жидком состоянии молекулы двигаются свободно. Но благодаря взаимному притяжению продолжают находиться друг от друга на расстоянии менее одного диаметра молекулы и часто испытывают столкновения. Если начать нагревать воду, то колебания молекул будут будут становиться сильнее, и количество столкновений их друг с другом возрастёт. Постепенно температура воды достигнет температуры кипения и вода начнёт превращаться в пар.
Энтальпия воды, энтальпия жидкости или физическая теплота воды(hf)
Энтальпия воды – это тепловая энергия, необходимая для повышения температуры воды с исходного значения 0ºС до ее температуры в данный момент времени.
В этом исходном состоянии, при температуре 0ºС, энтальпия воды приравнивается к нулю. После этого можно определить энтальпию всех прочих состояний по отношению к этому, достаточно просто получаемому состоянию.
Физическая теплота – это термин, который использовался раньше, поскольку изменение температуры достигалось благодаря добавлению
в воду тепла. Однако в наши дни обычно используют термин «энтальпия жидкости» или «энтальпия воды».
При атмосферном давлении (0 бари) вода кипит при температуре 100ºС, а для нагрева 1 кг воды с 0ºС до температуры кипения (100ºС)
требуется 419 кДж энергии. Из этих цифр можно получить значение удельной теплоемкости воды (Ср), равное 4,19 кДж/кгºС. Это значение используется в большинстве вычислений в диапазоне температур от 0ºС до 100ºС.
Пар
По мере повышения температуры и приближения воды к состоянию кипения, некоторые молекулы приобретают достаточно большую кинетическую энергию чтобы их скорость позволила им моментально вылететь из жидкости в пространство, расположенное над ней, не упав обратно в жидкость.
Дальнейший нагрев приводит к еще большему колебанию молекул, и их число, обладающих кинетической энергией, достаточной для того, чтобы покинуть жидкость, увеличивается. По мере приближения воды к точке кипения в ней образуются пузырьки пара, которые поднимаются к поверхности и «взрываются» на ней.
Если рассмотреть молекулярную структуру воды и пара, становится понятно, почему плотность пара намного меньше плотности воды. Дело в том, что молекулы пара находятся на гораздо большем расстоянии друг от друга, нежели молекулы воды. Таким образом, пространство непосредственно над поверхностью воды наполняется гораздо более редкими молекулами пара.
Когда число молекул, покидающих жидкость, становится больше, чем число молекул, возвращающихся в нее, вода начинает свободно испаряться. В этот момент она достигает точки кипения, или температуры насыщения, поскольку она становится насыщенной тепловой энергией.
Если давление остается неизменным, добавление тепла не будет приводить к повышению температуры, но приведёт к тому, что вода превратится в насыщенный пар. Температуры кипящей воды и насыщенного пара в одной и той же системе одинаковы, но тепловая энергия, содержащаяся в единице массы, у пара намного выше.
При атмосферном давлении температура насыщения составляет 100ºС. Однако, если повысить давление, то кипение и превращение воды в пар будет происходить при большей температуре.
Поэтому увеличение давления эффективно повышает как энтальпию воды, так и температуру насыщения. Соотношение между температурой насыщения и давлением известно под названием «кривая насыщения водяного пара» (см. Рисунок 2.1.1).
Кривая насыщения водяного пара

Рис 2.2.1 Кривая насыщения водяного пара
На этой кривой вода и пар могут сосуществовать при любом давлении, находясь при этом в условиях температуры насыщения.
-Пар в условиях, соответствующих области над кривой, называют перегретым паром.
Воду в условиях, соответствующих области под кривой, называют недогретой водой.
Если пар покидает котёл в том же количестве, в каком он в нем производится, то при добавлении тепла просто увеличится производительность котла. Если пару не давать покидать котёл, поддерживать приток тепла, направленный внутрь котла поток энергии будет больше, чем энергия, его покидающая. Излишек энергии приводит к повышению давления, что повышает температуру насыщения, поскольку температура насыщенного пара строго связана с его давлением.
На этой кривой вода и пар могут сосуществовать при любом давлении, находясь при этом в условиях температуры насыщения.
-Пар в условиях, соответствующих области над кривой, называют перегретым паром.
-Воду в условиях, соответствующих области под кривой, называют недогретой водой.
Если пар покидает котёл в том же количестве, в каком он в нем производится, то при добавлении тепла просто увеличится производительность котла. Если пару не давать покидать котёл, поддерживать приток тепла, направленный внутрь котла поток энергии будет больше, чем энергия, его покидающая. Излишек энергии приводит к повышению давления, что, в свою очередь, повышает температуру насыщения, поскольку температура насыщенного пара строго связана с его давлением.
Энтальпия испарения, или скрытая теплота (hfg)
Это – количество тепла, необходимое для измерения состояния воды при температуре кипения и превращения ее в пар. При этом температура пароводяной смеси не меняется, и вся энергия используется для изменения состояния из жидкого (вода) в газообразное (насыщенный пар).
Устаревший термин, «скрытая теплота», произошёл от того факта, что, несмотря на добавление тепла, температура не меняется. Однако в наши дни обычно используется термин «энтальпия испарения» или «энтальпия парообразования».
Как и при изменении состояния из твёрдого в жидкое (превращение льда в воду), процесс испарения обратим. Когда пар соприкасается с поверхностью, имеющей более низкую температуру, происходит конденсация, во время которой в окружающую среду выделяется такое же количество тепла, которое было израсходовано на образование этого пара.
Это можно рассматривать как полезную часть общего количества тепла, используемую для нагрева, поскольку именно эта часть содержащегося в паре тепла выделяется при конденсации пара и превращении его обратно в воду.
Энтальпия насыщенного пара, или полная теплота насыщенного пара
Это полная энергия, содержащаяся в насыщенном паре. Она попросту представляет собой сумму энтальпии воды и энтальпии испарения.
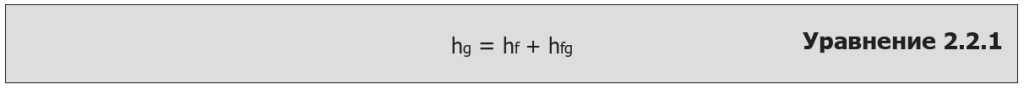
Где:
hg = Полная энтальпия насыщенного пара (полная теплота) (кДж/кг)
hf = Энтальпия жидкости (физическая теплота) (кДж/кг)
hfg = Энтальпия испарения (скрытая теплота) (кДж/кг)
Энтальпию (и другие свойства) насыщенного пара можно легко найти при помощи таблиц, составленных на основе результатов физических экспериментов. Это так называемые таблицы водяного пара.
Таблицы насыщенного пара
В таблицах водяного пара перечислены свойства пара при различных давлениях. Они составлены на основе проведённых с паром экспериментов. В Таблице 2.2.1 приведены свойства сухого насыщенного пара при атмосферном давлении – 0 бари.
Таблица 2.2.1 Свойства насыщенного пара при атмосферном давлении
| Давление пара, бари | Температура насыщения, С | Энтальпия (энергия) в кДж/кг – воды hf | Энтальпия (энергия) в кДж/кг – испарения hfg | Энтальпия (энергия) в кДж/кг – пара hg | Удельный объем сухого насыщенного пара, м3/кг |
| 0 | 100 | 419 | 2257 | 2676 | 1,673 |
Пример 2.2.1
При атмосферном давлении (0 бари) вода закипает при температуре 100ºС, а для нагрева 1 кг воды с 0ºС до температуры кипения (100ºС) требуется 419 кДж энергии. Поэтому удельная энтальпия воды при 0 бари и 100ºС равна 419 кДж/кг, что можно узнать из таблиц водяного пара (см. Таблицу 2.2.2).
Еще 2257 кДж энергии требуется для испарения 1 кг воды при температуре 100ºС и превращения ее в 1 кг пара, имеющего такую же температуру. Поэтому при 0 бари удельная энтальпия испарения составляет 2257 кДж/кг, что видно из таблиц водяного пара (см. Таблицу 2.2.2).
Следовательно: удельная энтальпия пара hg = 419 + 2257
hg=2676 кДж/кг при давлении 0 бари.
Однако практическое применение пара, имеющего атмосферное давление, весьма ограничено. Дело в том, что такой пар нельзя транспортировать при его собственном давлении по паропроводам в место использования.
Замечание: поскольку давление и удельный объём пара неразрывно связаны (при уменьшении объёма давление увеличивается), пар обычно производится в котле при давлении не менее 7 бари. Производство пара при высоких давлениях позволяет использовать распределительные трубопроводы небольшого диаметра.
По мере увеличения давления пара его плотность также увеличивается. Поскольку удельный объём обратно пропорционален плотности, при увеличении давления он уменьшается.
Связь между давлением и удельным объёмом водяного пара
На Рисунке 2.2.2 проиллюстрирована связь между удельным объёмом и давлением. На этом рисунке видно, что сильнее всего объём меняется при низких давлениях, тогда как с ростом давления удельный объём меняется очень мало.
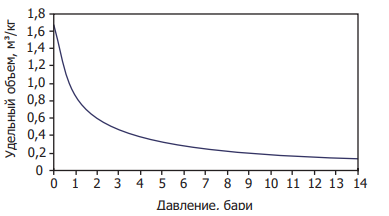
Рис. 2.2.2 Связь между давлением и удельным объёмом водяного пара
Фрагмент таблиц водяного пара, приведённый в Таблице 2.2.2, содержит удельный объём и другие данные, относящиеся к насыщенному пару.
При давлении 7 бари температура насыщения воды составляет 170ºС. Тогда для повышения температуры воды до температуры насыщения требуется больше энергии, нежели при атмосферном давлении. В таблице дано значение 721 кДж – это энергия, необходимая для нагрева 1 кг воды с 0º до температуры насыщения 170ºС.
Тепловая энергия (энтальпия испарения), необходимая для того, чтобы вода при давлении 7 бари превратилась в пар, на самом деле меньше, чем тепловая энергия, необходимая для этой цели при атмосферном давлении. Это связано тем, что при увеличении давления пара удельная энтальпия испарения уменьшается.
Однако, поскольку при повышении давления удельный объём также уменьшается, количество тепловой энергии, передаваемой такому же объёму, при повышении давления также увеличивается.
Таблица 2.2.2 Фрагмент таблиц насыщенного пара
| Давление пара (изб.) | Температура насыщения, С | Энтальпия (энергия) в кДж/кг – воды hf | Энтальпия (энергия) в кДж/кг – испарения hfg | Энтальпия (энергия) в кДж/кг – пара hg | Объем сухого насыщенного пара, м3/кг |
| 0 | 100 | 419 | 2257 | 2676 | 1,673 |
| 1 | 120 | 506 | 2201 | 2707 | 0,881 |
| 2 | 134 | 562 | 2163 | 2725 | 0,603 |
| 3 | 144 | 605 | 2133 | 2738 | 0,461 |
| 4 | 152 | 641 | 2108 | 2749 | 0,374 |
| 5 | 159 | 671 | 2086 | 2757 | 0,315 |
| 6 | 165 | 697 | 2066 | 2763 | 0,272 |
| 7 | 170 | 721 | 2048 | 2769 | 0,240 |
Читать вторую главу – Глава 2.2 Что такое пар? Часть 2. – ООО “НОСТ-СОЛЮШЕНС”
Читать статьи о паре и оборудовании на Яндекс. Дзен – NOST Solutions

